Электроды промышленной серии для измерения проводимости специально предназначены для измерения проводимости чистой воды, сверхчистой воды, в системах водоподготовки и т.д. Они особенно подходят для измерения проводимости на тепловых электростанциях и в водоочистной промышленности. Характерной особенностью является двухцилиндровая конструкция и материал из титанового сплава, который может естественным образом окисляться, образуя химическую пассивацию. Его антипроницаемая проводящая поверхность устойчива ко всем видам жидкостей, за исключением фтористых кислот. В качестве компонентов температурной компенсации используются: NTC2.252K, 2K, 10K, 20K, 30K, ptl00, ptl000 и др., которые указываются пользователем. Электроды с K=10,0 или K=30 имеют большую площадь платиновой структуры, устойчивой к сильным кислотам и щелочам и обладающей высокой защитой от загрязнения; они в основном используются для оперативного измерения проводимости в специализированных отраслях промышленности, таких как очистка сточных вод и очистка морской воды.
| Постоянная электрода | 0.1 | 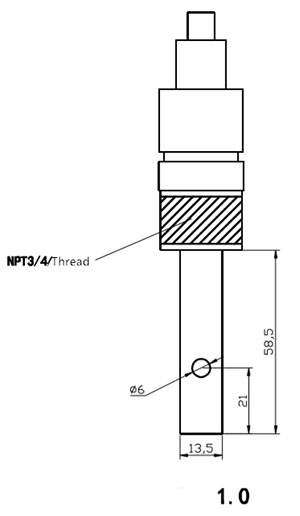 |
| Прочность на сжатие | 0,6 МПа | |
| Диапазон измерений | 0-200 мкСм/см | |
| Связь | Установка с резьбой 1/2 или 3/4 дюйма | |
| Материал | Нержавеющая сталь 316L | |
| Приложение | Водоочистная промышленность |
ПроводимостьЭто показатель способности воды пропускать электрический ток. Эта способность напрямую связана с концентрацией ионов в воде.
1. Эти проводящие ионы образуются из растворенных солей и неорганических веществ, таких как щелочи, хлориды, сульфиды и карбонатные соединения.
2. Соединения, растворяющиеся в ионах, также известны как электролиты 40. Чем больше ионов присутствует, тем выше проводимость воды. Аналогично, чем меньше ионов в воде, тем ниже ее проводимость. Дистиллированная или деионизированная вода может действовать как изолятор благодаря очень низкой (если не пренебрежимо малой) проводимости. Морская вода, напротив, обладает очень высокой проводимостью.
Ионы проводят электричество благодаря своим положительным и отрицательным зарядам.
При растворении электролитов в воде они расщепляются на положительно заряженные (катионы) и отрицательно заряженные (анионы) частицы. По мере расщепления растворенных веществ в воде концентрации каждого положительного и отрицательного заряда остаются равными. Это означает, что, несмотря на увеличение проводимости воды при добавлении ионов, она остается электрически нейтральной.


























